西宮の家庭教師ダイアログによる過去問解説。今回は神戸大学化学の過去問です。
もくじ
Ⅰ 状態変化とエネルギー

「状態変化とエネルギー」に関する問題です。見慣れないグラフの形ですが、実はおなじみの「氷を加熱していったときの温度変化と状態変化」のグラフの縦軸と横軸を入れ替えただけです。問われている内容は基本的なものですので、合格のためには全問正解したいところです。
問1 難易度:★☆☆☆☆
このグラフは、よく見る「氷を加熱していったときの温度変化と状態変化」のグラフの横軸と縦軸を入れ替えたものですね。
ということは、AB間→固体、BC間→固体と液体、CD間→液体、DE間→液体と気体ということになります。
問2 難易度:★☆☆☆☆
BC間に加えられたエネルギー(EC-EB)Jはnmolの分子結晶の融解に使われています。
よって、融解熱は、\frac{EC-EB}{n}〔J/mol〕
同様に考えて、蒸発熱は、\frac{EE-ED}{n}〔J/mol〕
問3 難易度:★★☆☆☆
問題文に「分子結晶Wgの温度を…」とありますから、固体での温度変化つまりAB間を見ればよいことになります。
グラフより、AB間で nmolの分子結晶を (T₂-T₁)K上昇させるのに(EB-EA)Jのエネルギーを要することになりますから、TK上昇させるためには、\frac{T(EB-EA)}{T₂-T₁}Jのエネルギーを要することが分かります。
分子量がMなので、nmolの質量はM・ngとなります。これを質量Wgで換算すると、
\frac{T(EB-EA)}{T₂-T₁}× \frac{W}{M・n}=\frac{W・T・(EB-EA)}{M・n・(T₂-T₁)}
となります。
問4 難易度:★☆☆☆☆
化学の記述問題では定番中の定番ですね。よく問われるので確実に答えられるようにしておきましょう。
【解答】
加えられたエネルギーが状態変化のためだけに使われるため。
問5 難易度:★★☆☆☆
氷は、圧力を大きくすると融点が下がります。これは、アイススケートがすべる理由としてよく知られていますね。
一方、ドライアイスは(二酸化炭素)は圧力を大きくすると融点が上がります。
これは、状態図の融解曲線が右上がりなのか右下がりなのかで異なります。
問6 難易度:★★☆☆☆
0℃の氷36gが0℃の水になるために必要な熱量は、
\frac{36}{18}〔mol〕×6.0〔kJ/mol〕=12〔kJ〕=12000〔J〕
50℃の水100gがもつ熱量と0℃の水100gがもつ熱量の差は、
50〔K〕×100〔g〕×4.2 〔J/(g・K)〕 =21000〔J〕
このうち、12000Jが氷の融解につかわれ、残り9000Jが0℃の水136gの温度上昇に使われたと考えると、上昇する温度は、
9000〔J〕÷4.2〔J/(g・K)〕÷136〔g〕=15.76…=16(K)
よって、物質の温度は16℃になります。
Ⅱ 銅の電解精錬

「銅の電解精錬」に関する問題です。頻出テーマではあるものの大問一つ全てこのテーマに使われることはそこまで多くありません。「酸化還元」や「ファラデーの法則」など基本的な知識を幅広く問う良問だと思います。
問1 難易度:★☆☆☆☆
銅の電解精錬では、粗銅板から銅がイオンになって溶解します。電子は導線を伝わって純銅板側に移動し、純銅板の表面にて電解液中の銅イオンが電子を受け取って純銅が析出します。
外部電源の正極側につながっている粗銅板側が陽極、負極につながっている純銅板側が陰極になります。

問2 難易度:★☆☆☆☆
問1で示した図のように粗銅板では銅がイオンとなって溶けだし、電子が放出されます。
Cu→Cu²⁺+2e⁻
問3 難易度:★★★☆☆
「電解精錬後に粗銅板の下に生成した沈殿」のことを陽極泥といいます。教科書的には、陽極泥には銅よりもイオン化傾向の小さい金属で、金や銀などの貴金属が含まれます。また、銅よりもイオン化傾向の大きい金属であっても、硫酸イオンと難溶性の塩を作ってしまうような金属は、沈殿となって粗銅板の下にたまってしまいます。よって、沈殿に含まれる金属元素は以下の2つです。
Ag:銅よりもイオン化傾向が小さいため。
Pb:難溶性の塩である硫酸鉛を生じるため。

硫酸イオンと難溶性の塩をつくる金属元素は、カルシウム、鉛、バリウムです。これらの塩は広く生活に利用されているので、関連づけて覚えましょう。
・硫酸カルシウム → 石膏
・硫酸鉛 → 鉛蓄電池(自動車のバッテリー)
・硫酸バリウム → レントゲン写真の造影剤
問4 難易度:★★☆☆☆
純銅板側では、以下の反応で純銅が析出します。
Cu²⁺+2e⁻→Cu
よって、電子2molあたり1molの銅が析出します。流れた電子の物質量はファラデー定数を用いて計算します。150Aで2時間40分50秒、すなわち9650秒電流が流れたときの電気量は、
150×9650=1447500(C)
よって、ファラデー定数を用いると、
1447500÷96500=15(mol)
だから、15molの電子が流れたことになります。よって、析出した銅の質量は、
63.5×15÷2=476.25≒4.76×10²(g)
問5 難易度:★★★☆☆
粗銅板では、銅だけでなく、銅よりもイオン化傾向の大きい金属がイオン化しています。それらも当然、イオンになるために電子を放出します。
一方、純銅板側では、電子を受け取るのは水溶液中で最もイオン化傾向の小さい銅イオンだけです。

よって、電解液において(粗銅板から供給される銅イオン)<(純銅板で消費される銅イオン)となります。つまり、電解精錬を続けると、電解液中の銅イオン濃度は少しずつ減少していきます。よって解答は以下の通りです。
【減少する】
理由:陽極ではCuだけでなく不純物のうち銅よりイオン化傾向の高い金属も酸化される。これに対し、陰極ではCu²⁺のみが還元される。陽極で発生したe⁻は全て陰極でのCu²⁺の還元に使われる。よって電解液中のCu²⁺について、陰極での析出による消費が陽極での溶解による供給を上回るので、Cu²⁺総量は減少する。
Ⅲ 有機化合物の構造決定

神戸大学の化学過去問(2020年度)「有機化合物の構造決定」の問題です。丁寧に誘導されており、問われる知識も教科書レベルのものです。正しい方法で基礎~標準レベルの演習がきっちりできていれば解けるはずです。
問1 難易度:★☆☆☆☆
Jは「ナトリウムフェノキシドと二酸化炭素を加熱・加圧して反応させた後、希硫酸で処理して生じた化合物」なので、サリチル酸であることが分かります。

問2 難易度:★★☆☆☆
問1よりA、B、C、Dはサリチル酸からつくられるエステルです。ただし、塩化鉄(Ⅲ)水溶液で呈色することから、 ヒドロキシ基ーOHは生きていて、カルボキシ基に何らかのアルコール(F、G、H、I)がエステル結合していると考えられます。
よって、F、G、H、Iはすべて金属ナトリウムと反応します。
問3 難易度:★★☆☆☆
サリチル酸はC₇H₆O₃で表されるのでF、G、H、Iの分子式をCxHyOzとおくと、
C₇H₆O₃ + CxHyOz → C₁₁H₁₄O₃ +H₂O
が成り立つのでF、G、H、Iの分子式は C₄H₁₀Oだと分かります。これらがアルコールだということは分かっているので、構造異性体のうち、候補は以下の4つです。

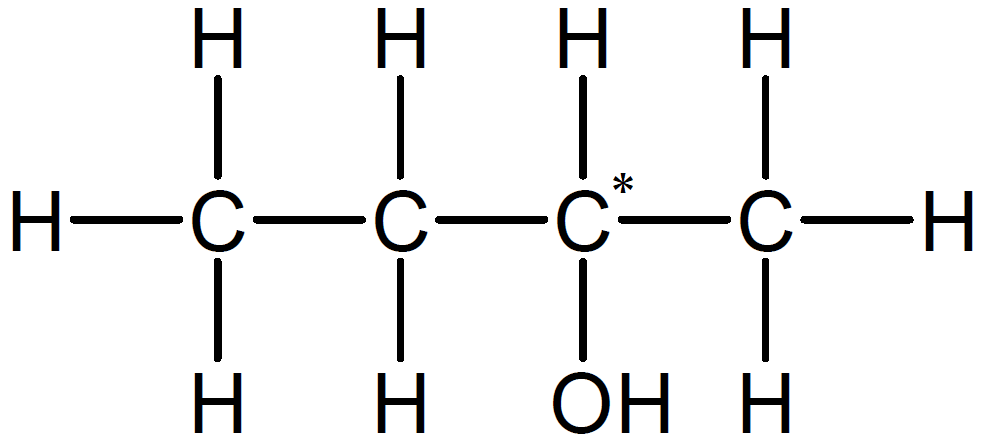

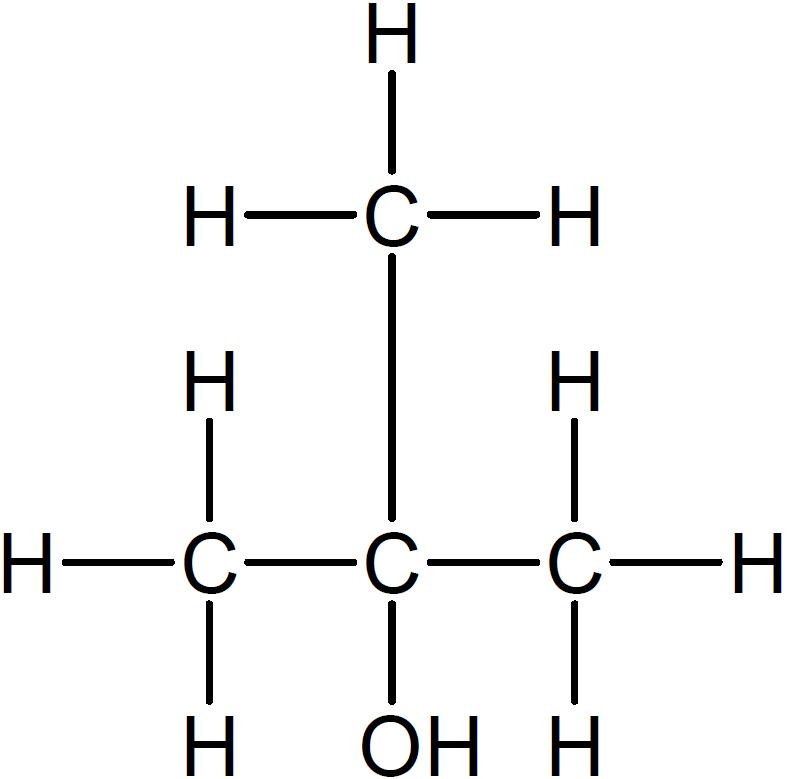
このうち、不斉炭素原子をもつのは2-ブタノールです。2-ブタノールは4つのアルコールのうち唯一、第二級アルコールです。問題文に「(酸化により)Fからケトンが生じた」とあるので、Fが2-ブタノールだと分かります。よって、不斉炭素原子をもつのはF。
問4 難易度:★★☆☆☆
問題文に「Iは酸化されなかった」とあるので、化合物Iは唯一の第三級アルコールである2-メチル-2-プロパノールだと分かります。よって、残りのGとHが第一級アルコールであり、酸化の過程で還元性をもつアルデヒドが得られます。よって、GとH。
問5 難易度:★★☆☆☆
ヨードホルム反応を示すのは以下の原子団をもつ物質です。

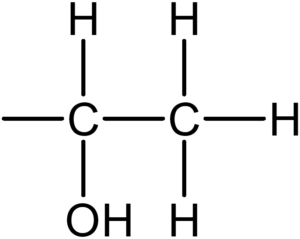
4つのアルコールのうち、この構造をもつのは2-ブタノールです。よって化合物F。
問6 難易度:★★☆☆☆
化合物F(2-ブタノール)を分子内脱水して得られるアルケンは、シス-トランス異性体も含めて以下の3種類です。

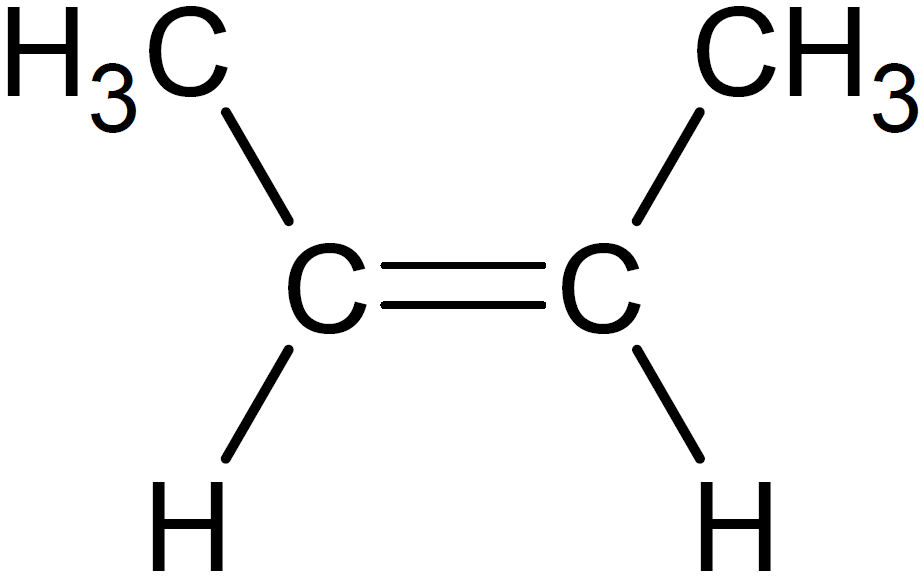
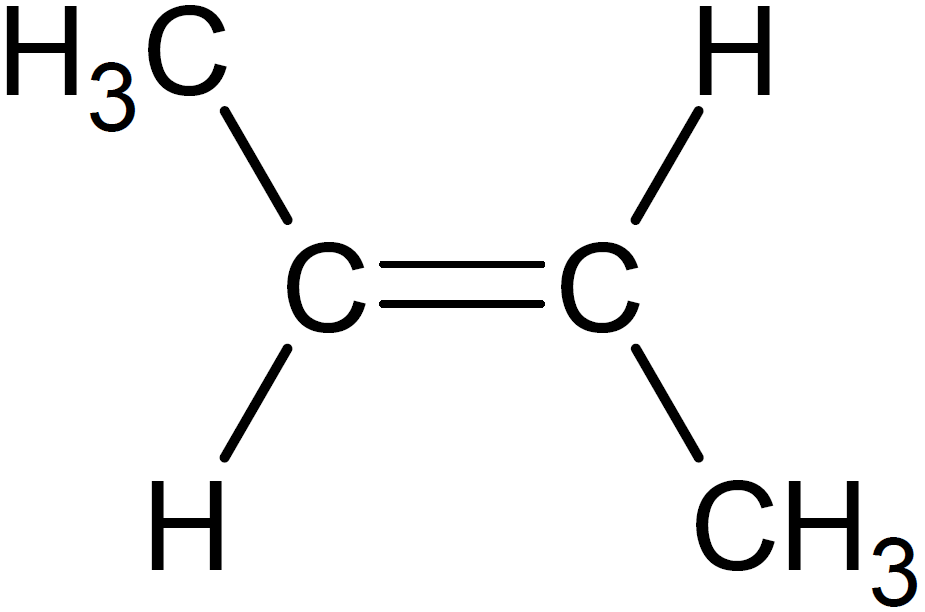
問7 難易度:★★★☆☆
化合物Eを加水分解して得られる化合物Mは1個のヒドロキシ基をもち、もう一つ「水素置換基」があることは分かっています。これをRとおきます。Rは加水分解されているので、その原子団にカルボキシ基もしくはヒドロキシ基をもつと考えられます。 また、Rに含まれる炭素数は0~3個で候補はとてもたくさんあります。さらにRとヒドロキシ基との位置関係は、オルト位(o-)、メタ位(m-)、パラ位(p-)の3通りあります。

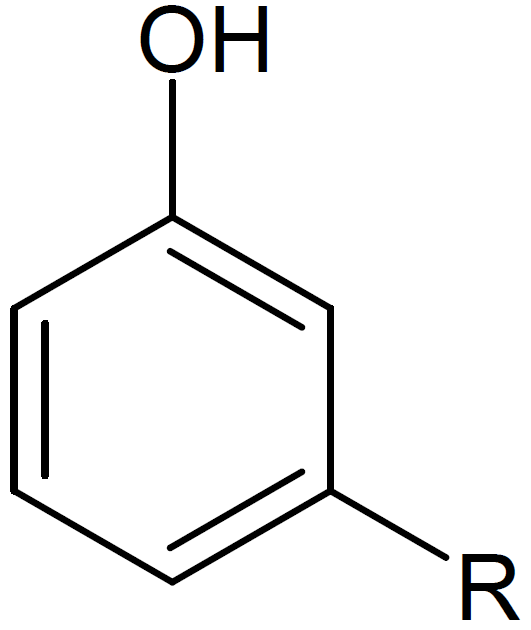
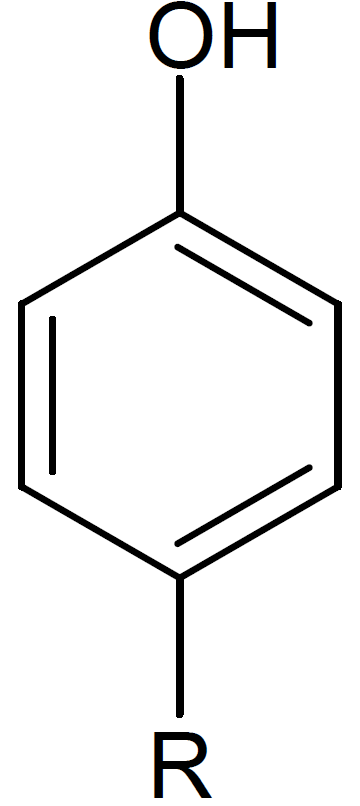
しかし「ベンゼン環上の水素原子の一つを塩素原子に置換」すると、異性体の数はオルト位とメタ位は4種類、パラ位は2種類になってしまうので、条件に合いません。実際に描いてみると分かります。
ただし、Rもヒドロキシ基の場合、つまりベンゼン環にヒドロキシ基が2つ付く場合は特別です。2つのヒドロキシ基がメタ位に付いたときに「水素原子の一つを塩素原子に置換した化合物には 3 種類の異性体が存在」します。

よって、化合物Mの構造式は下図のとおりです。m-ベンゼンジオールといいます。

Ⅳ 酵素反応の速度

「酵素反応の速度(ミカエリス・メンテン式)」に関する問題です。難関大(旧帝大や神戸大学レベル)の化学対策をしていると一度は出会うテーマですね。正直なところ、初見で問5と問7の設問に回答するのは困難です。理系難関大を狙う受験生はこの機会にしっかり学んでおきましょう。
ポイントは、問5は反応速度式V=…の逆数を取ること、問7は基質濃度[S]にKmを代入することです。
問1 難易度:★★☆☆☆
アミノ酸のもつカルボキシ基は酸性、アミノ基は塩基性を示す官能基です。
アミノ酸は中性水溶液中で電離すると、分子内に正と負の両電荷をもつ双性イオンとなります。
タンパク質のように、鎖状高分子をつくるアミド結合を特にペプチド結合といいます。
問2 難易度:★★☆☆☆
中性水溶液中での正味の電荷は、アミノ酸の側鎖の種類によって異なります。
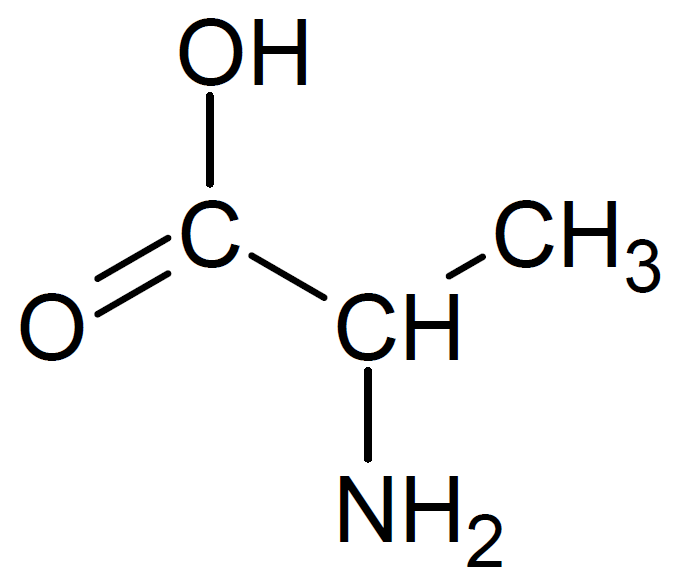
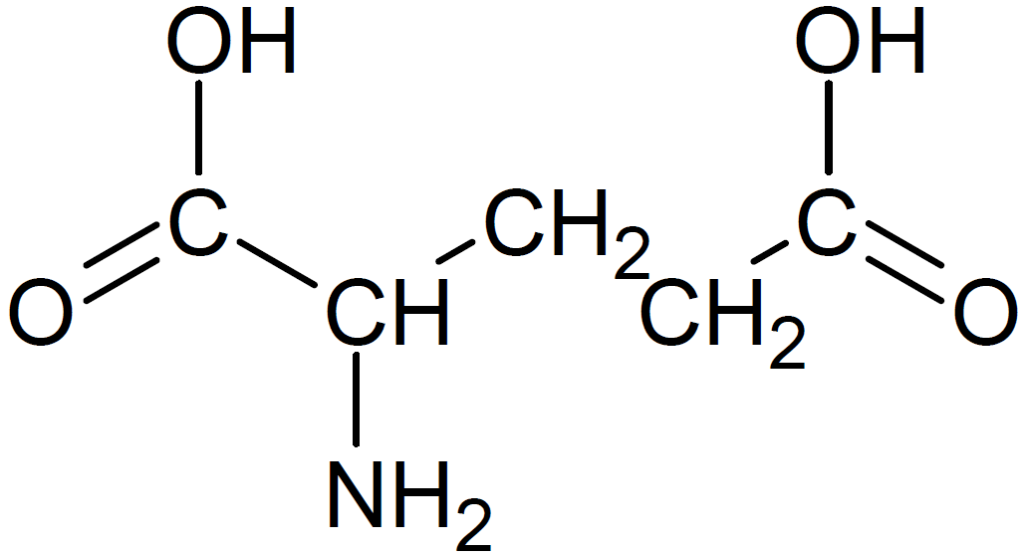
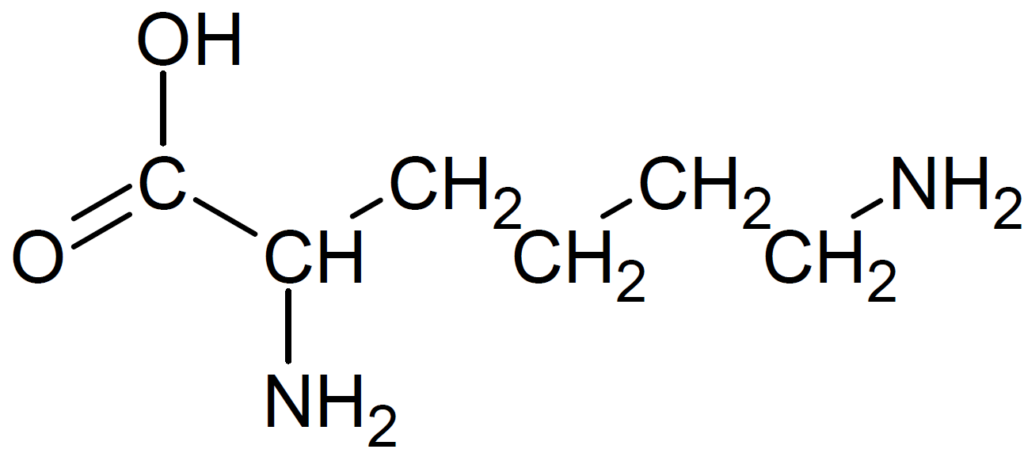
グルタミン酸は側鎖にカルボキシ基、リシンはアミノ基を含んでいます。アラニンの側鎖はメチル基です。
よって、中性水溶液中での正味の電荷を価数で表すと、その値はアラニンでは0、グルタミン酸では-1、リシンでは +1となります。
問3 難易度:★★☆☆☆
アミノ基をもつ物質と無水酢酸を反応させると脱水縮合し、アセチル化が起こります。
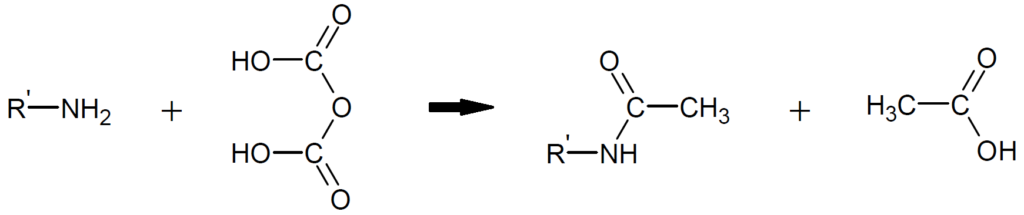
問4 難易度:★★★☆☆
問3より、アミノ基が1個アセチル化されると、水素原子(-H)がアセチル基(-COCH₃)に置き換わるので、分子量の増加は、
(12×2+16×1+1×3)-(1×1)=42
シトクロムcに無水酢酸を作用させアセチル化させると、分子量が13160-12360=800増加することから、シトクロムcに含まれるアミノ基の数は、800÷42≒19(個)
問5 難易度:★★★★☆
(2)式について、両辺の逆数を取ると、
\frac{1}{V}=\frac{Km+[S]}{k₃[E]t[S]}=\frac{Km}{k₃[E]t[S]}+\frac{1}{k₃[E]t}
Km、k₃、[E]tが一定なので、 \frac{1}{V}の値は[S]の値でのみ変化します。[S]が大きければ大きいほど\frac{Km}{k₃[E]t[S]} はゼロに近づきます。このとき、\frac{1}{V}の値は最も小さく、Vの値は最も大きくなることになります。
つまり、[S]=∞のとき、\frac{1}{Vmax}=0+ \frac{1}{k₃[E]t}=\frac{1}{k₃[E]t}
よって、Vmax=k₃[E]t
問6 難易度:★★☆☆☆
値を代入するだけです。
Km=\frac{k₂+k₃}{k₁}
=\frac{1000/s+10(/s)}{5.05×10⁸L/(mol・s)}
=\frac{1010}{5.05×10⁸}
=2.0×10⁻⁶ mol/L
問7 難易度:★★★★☆
Vmax=k₃[E]t
=10(/s)× 1.0×10⁻⁶(mol/L)
=1.0×10⁻⁵(mol/L・s)
よって、グラフは下のようになります。

V=\frac{k₃[E]t[S]}{Km+[S]}
これにKm=[S]を代入すると、V=\frac{k₃[E]t}{2}=\frac{Vmax}{2}
つまり、基質濃度がKmの値と等しいとき、反応速度はVmaxの半分になります。
よって、以下の条件を満たすようにグラフをかきます。
・基質濃度が0のときは反応速度0
・基質濃度がKm=2.0×10⁻⁶ mol/Lのとき反応速度は\frac{Vmax}{2}
・グラフは直線V=Vmax=1.0×10⁻⁵(mol/L・s) にだんだん近づく曲線

.png)


