今回は神戸大学2018年度入試 化学の過去問です。
もくじ
Ⅰ 化学反応と分圧

「化学反応と分圧」に関する問題です。計算量はやや多いですが、特に難しい設問もなく、ミスに気を付ければ全問正解が可能です。
問1 難易度:★★★☆☆
一酸化窒素NOと酸素O₂から二酸化窒素NO₂が生じる化学反応の反応式は、
2NO + O₂ → 2NO₂
問2 難易度:★★☆☆☆
全圧をPとし、酸素O₂、一酸化窒素NO、アルゴンArの分圧をそれぞれPO₂、PNO、PArとします。
PO₂=2.00×10⁴ × \frac{1}{4}=5.00×10³(Pa)
PNO=1.00×10⁴ × \frac{2}{4}=5.00×10³(Pa)
PAr=4.00×10⁴ × \frac{1}{4}=1.00×10⁴(Pa)
よって、P= PO₂+PNO+PAr=2.00×10⁴(Pa)
問3 難易度:★★★☆☆
問1より、反応する一酸化窒素NOと酸素O₂ および発生する二酸化窒素NO₂の物質量の比は、2:1:2となります。また、問2で求めた各気体の分圧の比がそのまま物質量の比となりますので、NOがなくなった時の各気体の分圧は、
PO₂=5.00×10³-5.00×10³×\frac{2}{4}=2.50 ×10³ (Pa)
PNO=0(Pa)
PAr=1.00×10⁴(Pa)
PNO₂=5.00×10³(Pa)
よって、P=2.50×10³+0+1.00×10⁴+5.00×10³=1.75×10⁴(Pa)
問4 難易度:★★☆☆☆
コックを開ける前の容器B内の気体(一酸化窒素NO)の質量を求めると、次のように表せます。
30×\frac{1.00×10⁴×2}{RT}=\frac{6.00×10⁵}{RT}(g)
次に、反応後の質量を求めるために、反応後の気体の平均分子量を求めます。平均分子量は成分気体の分子量にその物質量の存在比を乗じて算出しますが、分圧を使っても出すことができます。
\frac{32×2.50 ×10³+40×1.00×10⁴+46×5.00×10³}{1.75×10⁴}=\frac{7.10×10⁵}{1.75×10⁴}
よって、反応後の質量は、
\frac{7.10×10⁵}{1.75×10⁴}×\frac{1.75×10⁴×2}{RT}=\frac{14.2×10⁵}{RT}
よって、コックを開ける前と反応後の容器Bに含まれる気体の質量の差は、
\frac{14.2×10⁵}{RT}-\frac{6.00×10⁵}{RT}=\frac{8.2×10⁵}{8.31×10³×310}=0.3183…≒0.318(g)
問5 難易度:★★☆☆☆
本文の前提条件として「逆反応は進行せず」とありますので、反応速度は一定であったと考えられます。よって、グラフは直線となり、下図のように2.00×10⁴Paと1.75×10⁴Paを結べばよいことになります。

Ⅱ 沈殿の生成と濃度決定

「沈殿の生成と濃度決定」に関する問題です。無機化学の標準的な知識が問われ、計算量もありますので、力試しにもってこいの良問です。
問1 難易度:★★★☆☆
何個正解があるか分からないので、ひとつひとつ選択肢を吟味していきます。
(ア)白金Ptと銀Agでは銀の方がイオン化傾向が大きいので、樹状結晶が析出することはありません。×
(イ)Ag⁺が存在するところに硫化物イオンS²⁻を加えると硫化銀Ag₂Sの黒色沈殿を生じます。〇
(ウ) Ag⁺が存在するところに塩化物イオンCl⁻を加えると塩化銀AgClの白色沈殿が生じます。これは熱水には溶けません。熱水に溶けるのは塩化鉛PbCl₂でしたね。 ×
(エ) Ag⁺が存在するところに塩基を加えると酸化銀Ag₂Oの褐色沈殿が生じます。過剰のアンモニアを加えると、錯イオンであるジアンミン銀(Ⅰ)イオン[Ag(NH₃)]⁺を生じて溶解します。 〇
(オ)ハロゲン化銀のうち難溶性のものは塩化銀AgClのみです。×
(カ)硝酸銀AgNO₃水溶液を電気分解すると、陰極では銀Agの単体が析出し、陽極では気体(酸素O₂)が発生します。〇
問2 難易度:★★☆☆☆
考えられる沈殿は塩化銀AgCl(白色)とクロム酸銀(Ⅰ)Ag₂CrO₄(赤褐色・暗赤色)です。本文に「B液を13.5mL滴下した時にうすい暗赤色のAg₂CrO₄の沈殿が生成」とありますので、一滴加えたときに生成したのは塩化銀だと分かります。
よって、色は白です。
問3 難易度:★★★☆☆
②5.00×10⁻²mol/LのAgNO₃水溶液を3.00×10⁻²mLを15mLのA液に加えるので、滴下による体積変化を無視でき、かつ沈殿ができなかったとするとAg⁺の濃度は
5.00×10⁻²×\frac{3.00×10⁻²}{1000}÷\frac{15}{1000}=1.00×10⁻⁴(mol/L)
③沈殿を生じる前の濃度が塩化銀の溶解度積Ksp(AgCl)を超えているので、
[Ag⁺][Cl⁻]>1.80×10⁻¹⁰ だから,
[Cl⁻]>1.80×10⁻¹⁰÷(1.00×10⁻⁴)=1.80×10⁻⁶(mol/L)
④[Ag⁺]=[Cl⁻]かつ、
Ksp(AgCl)=[Ag⁺][Cl⁻]=1.80×10⁻¹⁰より、
[Cl⁻]²=1.80×10⁻¹⁰ なので、
[Cl⁻]= \footnotesize\sqrt{1.80×10⁻¹⁰}=1.34×10⁻⁵(mol/L)
⑤[Ag⁺]=[Cl⁻]=1.34×10⁻⁵(mol/L)
⑥加えたクロム酸カリウムK₂CrO₄は2.85×10⁻⁴molであるから、Ag₂CrO₄の沈殿が生成しはじめるときのクロム酸イオン濃度は、
[CrO₄²⁻]=2.85×10⁻⁴÷\frac{15+13.5}{1000}=1.00×10⁻²(mol/L)
よって、クロム酸銀(Ⅰ)Ag₂CrO₄の沈殿が生成しはじめるときの銀イオン濃度は、
[Ag⁺]²[CrO₄²⁻]=4.00×10⁻¹²
[Ag⁺]²=\frac{4.00×10⁻¹²}{1.00×10⁻²}=4.00×10⁻¹⁰
よって、[Ag⁺]=\footnotesize\sqrt{4.00×10⁻¹⁰}=2.00×10⁻⁵(mol/L)
問4 難易度:★☆☆☆☆
1.34×10⁻⁵< 2.00×10⁻⁵だから、⑥の値は⑤の値よりも大きくなります。
問5 難易度:★★★☆☆
B液13.5mL中に含まれる銀イオンの物質量は、
5.00×10⁻²×\frac{13.5}{1000}=6.75×10⁻⁴(mol)
本文の通り、ここでAgClの沈殿生成が完了したと考えると、A液15.0mLにはこれと等しい物質量の塩化物イオン、すなわち同じ物質量の塩化ナトリウムが含まれていることになります。
NaCl=58.5なので、その質量は、58.5×6.75×10⁻⁴(g)
このA液はしょう油を体積比で50倍にうすめたものなので、うすめる前のしょう油15mLに含まれる塩化ナトリウムの質量はこの50倍です。
58.5×6.75×10⁻⁴ ×50=1.974375≒1.97(g)
Ⅲ 有機化合物の構造決定

「有機化合物の構造決定」の問題です。「脂環式化合物」や「環状エーテル化合物」など教科書には載っていない用語が説明なく使われていますので、意味を推定しながら解く必要があります。設問自体は標準的な難易度でしょう。
問1 難易度:★★★☆☆
まずC₅H₁₀Oについて、Cの原子数をnとするとHの原子数は2nなので、不飽和度は1です。
(ア)脂環式化合物は、その名前から環状構造が炭素および水素からなる化合物だと考えられます。これらの化合物は、環状構造をもっていることで不飽和度が1上昇していますので、鎖状構造の部分には不飽和度が上昇するような官能基(アルデヒド基やケトン基など)はもたないことがわかります。
よって、(ア)は「アルコール」であるとわかります。
(イ)(ウ)環状エーテル化合物群は環状構造中にエーテル基(-C-O-C-)をもつものだと考えられます。可能な環員数を考えると、最小は3員環で、最大は5個全ての炭素と1個の酸素を使った6員環だと分かります。
(エ)(オ)炭素-酸素二重結合をもつ化合物はカルボニル基をもちます。その炭素原子に結合する炭素原子の数が1個なら(つまり鎖状構造の端っこにあれば)アルデヒド、2個なら(つまり鎖状構造の途中なら)ケトンとなります。
これらの化合物のうち、不斉炭素原子をもつのは下図の化合物だけなので、(エ)が「アルデヒド」、(オ)が「ケトン」だと分かります。

問2 難易度:★★☆☆☆
脂環式化合物群なので、環状構造は炭素のみでつくられます。炭素4個による4員環構造とエーテル基をもつのは下図の化合物のみです。

問3 難易度:★★★☆☆
環状エーテル化合物群のうち、環員数が4のものを考えます。まず環状構造自体は一通りしかありません。そこには炭素が3個使われることになりますので、残り2個の炭素をどうくっつくけるかのバリエーションを考えればよいことになります。ただし、不斉炭素原子をもつものは除外します。
まず、メチル基を2つくっつける場合は下図の2通りです。

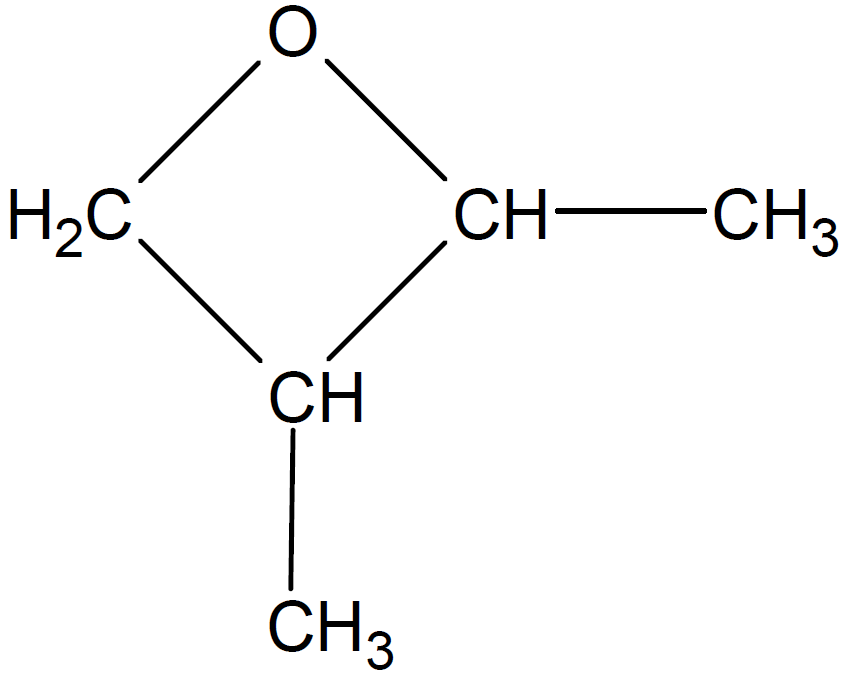
また、エチル基を1つくっつける場合は下図の2通りですが、このうち左の化合物は不斉炭素原子をもってしまうので、除外します。


問4 難易度:★★★★☆
炭素-炭素間二重結合をもつ鎖式化合物のうち、不斉炭素原子をもつものを考えます。こういった問題は、不斉炭素原子を中心に、4つの異なる原子団をくっつけていく考え方で解きます。
【化合物B】
「水素を付加反応により化合物Bは不斉炭素原子が消失する」が最大のヒントです。つまり、水素を付加し二重結合を単結合に還元すると、同一の原子団になる2つの原子団が不斉炭素原子に結合していることになります。
炭素数の制限から考えて、その2つの原子団は「-C₂H₅」と「-CH=CH₂」です。すると、中心となる不斉炭素原子を加えると炭素数5を使い切ってしまうので、残りの原子団は「-H」と「-OH」しかありえません。よって、化合物Bの構造式は下図のようになります。ヒドロキシ基をもちますので、「金属ナトリウムと反応して水素を発生する」という条件にも当てはまります。

【化合物C】
「金属ナトリウムを加えても水素を発生しない」ことから、化合物Cはヒドロキシ基をもたず、酸素原子はエーテル基につかわれることが分かります。エーテル基を含む原子団として考えられるものをリストアップしていくと 「-O-CH₃」「-CH₂-O-CH₃」「-O-CH=CH₂」などが考えられます。
ただ、使えるCの数は全部で5個と少ないので、エーテル基を含む原子団では炭素数を節約し「-O-CH₃」に決めます。さらに炭素原子の節約のために原子団の1つを「-H」とすると、残りは C3個、H7個です。残り2つの原子団のうち1つに炭素-炭素間二重結合をもたせればよいので、「-CH=CH₂」「-CH₃」となります。以上より、化合物Cは下図の通りです。

問5 難易度:★★☆☆☆
問1(エ)でも示したように、化合物Dは下図の通りです。

Ⅳ 天然繊維と合成繊維

「天然繊維と合成繊維」に関する問題です。教科書の内容を逸脱しない標準的なレベルの問題です。
問1 難易度:★★★☆☆
(ア)(イ)(ウ)(エ)タンパク質の分子構造において、らせん状のものをα-ヘリックス構造、ジグザク状のものをβ-シート構造といい、これらの構造では分子間で水素結合がみられます。こういった構造をタンパク質の2次構造といいます。
(オ)酢酸ビニルのビニル基の二重結合の部分を開きながら共有結合(付加重合)させることで、ポリ酢酸ビニルが得られます。
(カ)酢酸ビニルはビニルアルコールと酢酸のエステルです。よって、ポリ酢酸ビニルを水酸化ナトリウムでけん化するとポリビニルアルコールが得られます。
(キ)ポリビニルアルコールのヒドロキシ基をホルムアルデヒドを用いて部分的にアセタール化すると、ビニロンが得られます。
(ク)アクリロニトリルもビニル基をもっています。付加重合することでポリアクリロニトリルが得られます。これを不活性気体中で加熱し熱分解すると炭素繊維(カーボンファイバー)が得られます。
問2 難易度:★★☆☆☆
タンパク質の立体構造にかかわる水素結合は、おもにアミド結合における酸素原子(=O)と窒素原子と共有結合した水素原子(NH)の間に形成されます。
よって、(コ)がC、(サ)がO、(シ)がHとなります。
問3 難易度:★★☆☆☆
モノマーであるビニルアルコール(CH₂=CHOH)の分子量は44です。付加重合では二重結合が開いて結合するので、小さな分子が取れたりすることはありません。よって、このポリビニルアルコールの重合度は、
6.60×10⁴÷44=1.50×10³=1500
よって、このポリビニルアルコールに存在するヒドロキシ基も、1500個です。
問4 難易度:★★★☆☆
ホルムアルデヒドを加えてアセタール化すると、下図のような反応が起きます。
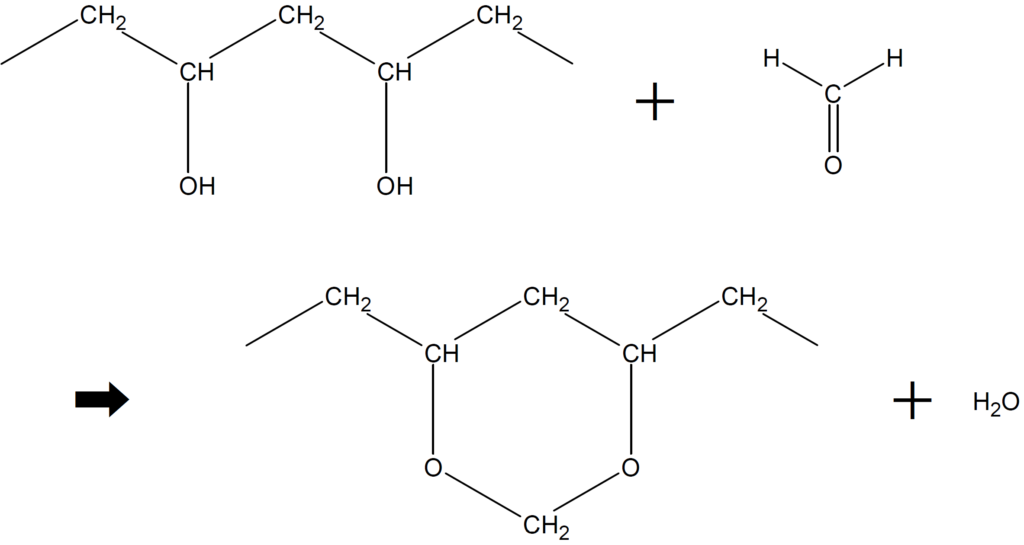
2個のヒドロキシ基(-OH)と1分子のホルムアルデヒドHCHOから1分子の水がとれて架橋構造(-O-CH₂-O-)ができます。
これによって増加する分子量を計算すると、
30-18=12
つまり、ヒドロキシ基2個がアセタール化されると分子量が12増えることになります。よって、1500個あるヒドロキシ基の40%がアセタール化すると、
12×1500× \frac{40}{100}÷2=3600
だけ分子量が増加します。これはもとの分子量の、
3600÷(6.60×10⁴)×100=5.454…≒5.45(%)
にあたります。
.png)


